Le ulcere del piede diabetico rappresentano la principale causa di ospedalizzazione ed amputazione maggiore degli arti inferiori1,2.
La causa principale di amputazione è quasi sempre legata alla presenza di arteriopatia obliterante periferica (AOP), che nei pazienti con diabete spesso si presenta con quadri a evoluzione più rapida e più grave rispetto ai soggetti non diabetici3. La presenza di ischemia critica agli arti inferiori (il termine medico “ischemia” identifica qualsiasi riduzione o interruzione dell’apporto di sangue in un distretto corporeo) nei diabetici può raggiungere prevalenze di quasi il 25% con prognosi quod vitam4 («per ciò che riguarda la vita») e quod functionem5 («per ciò che riguarda la funzione e la possibilità di recupero funzionale ») molto sfavorevole se non tempestivamente riconosciuta e trattata6.
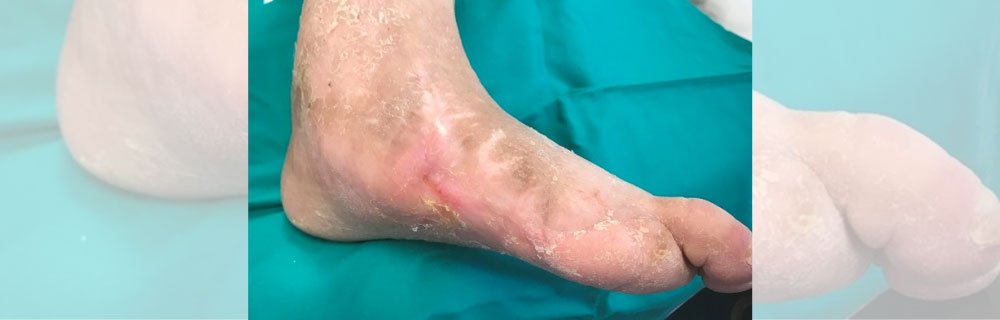
Le sedi più frequenti dell’ulcera ischemica sono quelle marginali del piede2 (Figura 1), dove la circolazione terminale periferica non permette un margine sufficiente di compenso emodinamico.
L’approccio terapeutico ai pazienti diabetici con Arteriopatia Obliterante Periferica (termine medico che indica una patologia vascolare contraddistinta da un’occlusione più o meno grave delle arterie destinate a irrorare gli arti, il tronco o il capo) è fondamentalmente legato alle possibilità di effettuare una efficace rivascolarizzazione dell’arto inferiore colpito.
Le attuali tecniche di rivascolarizzazione
Fino a pochi anni fa, l’unica opzione terapeutica era la via chirurgica (by-pass)7; successivamente agli inizi degli anni ’90 hanno preso sempre più campo le procedure endovascolari (PTA) che hanno modificato l’approccio all’ischemia periferica soprattutto nei pazienti con diabete. Infatti le procedure endoluminali (s’intende il lume interno dei vasi) hanno compiuto negli ultimi anni notevoli progressi in termini di efficacia, durabilità e sicurezza8 tali da, specie in Italia, far prediligere questa modalità di rivascolarizzazione a quella tradizionale9.
Purtroppo però, qualunque approccio venga utilizzato, un’elevata proporzione (circa il 25%) di pazienti affetti da Arteriopatia Obliterante Periferica (AOP) non risultano essere rivascolarizzabili (ad es, per la presenza di elevata comorbidità (altre malattie associate), estese calcificazioni dell’intima-media (strato più interno e medio della parete vasale), assenza di vene adatte ad effettuare un by-pass, e altre motivazioni.10).
I pazienti diabetici con una ischemia critica non rivascolarizzabile (o non ulteriormente rivascolarizzabile) rispetto ai soggetti che vengono rivascolarizzati, sono quelli a maggior rischio di amputazione maggiore (30% vs. 4.5%) e di eventi fatali (50% vs. 8.9%)11-13.
Buone prospettive dalla terapia cellulare autologa
In questi casi, negli ultimi anni, la terapia cellulare autologa (con utilizzo di cellule staminali di origine mesenchimale o cellule mononucleate prelevate da circolo ematico) è risultata un approccio promettente per il trattamento dell’ischemia critica no option, in grado di promuovere l’angiogenesi (generazione di nuovi vasi sanguigni) e la riparazione tissutale. La terapia cellulare autologa, infatti, ha mostrato effetti favorevoli su diversi esiti, come il dolore, la tensione transcutanea di ossigeno, la guarigione dell’ulcera, l’amputazione maggiore e la mortalità14.
Cellule quali monociti, macrofagi e linfociti da sangue periferico (Peripheral Blood Mononuclear Cells: PBMNC) sembrano, infatti, aumentare la circolazione periferica tramite la stimolazione della neo-angiogenesi attraverso molteplici fattori di crescita15-21. Tale capacità angiogenica aumenta nel tessuto ischemico16,20,21 ed è mantenuta anche nei pazienti con diabete22. Un’altra azione fondamentale delle PBMNC è quella di stimolare i processi di guarigione tissutale23-25, che è stata dimostrata anche in pazienti diabetici affetti da ulcere del piede diabetico26,29,34,36.
I monociti [un tipo di globuli bianchi (leucociti) che svolgono più ruoli nell’ambito delle nostre prime difese immunitarie, dei veri e propri “spazzini”] inoltre, sono in grado di attivare la conversione dei macrofagi infiammatori M1 (cellule immunitarie altamente differenziate), presenti in alte concentrazioni in tutte le lesioni croniche, in particolare nel piede diabetico27, in macrofagi M2, dotati di proprietà antinfiammatorie e rigenerative. Il rilascio, infine, di sostanze oppioidi naturali da parte dei macrofagi M228 determina un’importante azione antidolorifica, alleviando sensibilmente la sintomatologia dolorifica dal paziente.
La terapia cellulare può essere somministrata attraverso vie e metodologie diverse:
- l’iniezione intramuscolare;
- l’infusione endovenosa;
- l’iniezione diretta nel tessuto o nel muscolo bersaglio;
- la somministrazione attraverso specifici supporti bioattivi29.
Le cellule autologhe mononucleate da sangue periferico
Negli ultimi anni, alcuni Autori hanno proposto l’iniezione intramuscolare di PBMNC autologhe prelevate da sangue periferico che, similmente alle cellule progenitrici midollari, possiedono ottime proprietà neo-angiogeniche16,20 e rigenerative15.
Inoltre, questo nuovo approccio presenta diversi vantaggi, come l’impiego di tecniche di estrazione meno invasive, procedure più brevi e meno dolorose e ripetibili nel tempo19,29,30.
Note conclusive
Qualunque sia la linea cellulare utilizzata e la via di somministrazione impiegata, la terapia cellulare autologa nei pazienti con ulcere cutanee ischemiche si è rivelata una valida opzione specie nei casi di arteriopatia obliterante periferica non rivascolarizzabile 14,31, come dimostrato da numerose metanalisi di studi randomizzati e osservazionali14,31. In particolare, una metanalisi prodotta dal nostro gruppo di ricerca, ha dimostrato come le PBMNC riducevano in modo significativo i tassi di amputazione maggiore in pazienti con ischemia critica non-option14.
Nonostante vi possano essere dei dubbi sull’efficacia di tali terapie nel paziente diabetico, in quanto la presenza di diabete può alterare in maniera significativa le proprietà angiogeniche e rigenerative delle popolazioni cellulari midollari utilizzate14,31-33, la maggior parte delle evidenze sembra non mostrare differenti profili di azione della terapia cellullare con PBMNC nella popolazione con diabete. 34-37
Figura 1 – Evoluzione dei risultati ottenuti con la terapia cellulare autologa
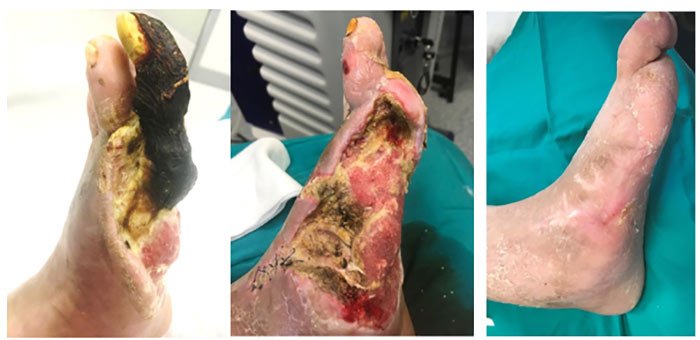
Figura 2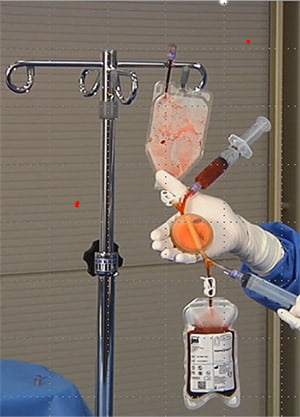
References
- Ebskov B, Josephsen P. Incidence of reamputation and death after gangrene of the lower extremity. Prosthet Orthot Int 1980;4(2):77-80. (In eng). DOI: 10.3109/03093648009164567
- Meloni M, Izzo V, Giurato L, Lázaro-Martínez JL, Uccioli L. Prevalence, Clinical Aspects and Outcomes in a Large Cohort of Persons with Diabetic Foot Disease: Comparison between Neuropathic and Ischemic Ulcers. J Clin Med 2020;9(6) (In eng). DOI: 10.3390/jcm9061780
- Thiruvoipati T, Kielhorn CE, Armstrong EJ. Peripheral artery disease in patients with diabetes: Epidemiology, mechanisms, and outcomes. World J Diabetes 2015;6(7):961-9. (In eng). DOI: 10.4239/wjd.v6.i7.961
- Elsayed S, Clavijo LC. Critical limb ischemia. Cardiol Clin 2015;33(1):37-47. (In eng). DOI: 10.1016/j.ccl.2014.09.008
- Reinecke H, Unrath M, Freisinger E, et al. Peripheral arterial disease and critical limb ischaemia: still poor outcomes and lack of guideline adherence. Eur Heart J 2015;36(15):932-8. (In eng). DOI: 10.1093/eurheartj/ehv006
- Pecoraro RE, Reiber GE, Burgess EM. Pathways to diabetic limb amputation. Basis for prevention. Diabetes Care 1990;13(5):513-21. (In eng). DOI: 10.2337/diacare.13.5.513
- Romiti M, Albers M, Brochado-Neto FC, Durazzo AE, Pereira CA, De Luccia N. Meta-analysis of infrapopliteal angioplasty for chronic critical limb ischemia. J Vasc Surg 2008;47(5):975-981. (In eng). DOI: 10.1016/j.jvs.2008.01.005
- Conte MS, Bradbury AW, Kolh P, et al. Global Vascular Guidelines on the Management of Chronic Limb-Threatening Ischemia. Eur J Vasc Endovasc Surg 2019;58(1s):S1-S109.e33. (In eng). DOI: 10.1016/j.ejvs.2019.05.006
- Setacci C, Sirignano P, Galzerano G, et al. Endovascular first as “preliminary approach” for critical limb ischemia and diabetic foot. J Cardiovasc Surg (Torino) 2013;54(6):679-84. (In eng)
- Antoniou GA, Georgiadis GS, Antoniou SA, Makar RR, Smout JD, Torella F. Bypass surgery for chronic lower limb ischaemia. Cochrane Database Syst Rev 2017;4(4):Cd002000. (In eng). DOI: 10.1002/14651858.CD002000.pub3
- Antonopoulos CN, Mylonas SN, Moulakakis KG, et al. A network meta-analysis of randomized controlled trials comparing treatment modalities for de novo superficial femoral artery occlusive lesions. J Vasc Surg 2017;65(1):234-245.e11. (In eng). DOI: 10.1016/j.jvs.2016.08.095
- Ferraresi R, Mauri G, Losurdo F, et al. BAD transmission and SAD distribution: a new scenario for critical limb ischemia. J Cardiovasc Surg (Torino) 2018;59(5):655-664. (In eng). DOI: 10.23736/s0021-9509.18.10572-6
- Ferraresi R, Ucci A, Pizzuto A, et al. A Novel Scoring System for Small Artery Disease and Medial Arterial Calcification Is Strongly Associated With Major Adverse Limb Events in Patients With Chronic Limb-Threatening Ischemia. J Endovasc Ther 2021;28(2):194-207. (In eng). DOI: 10.1177/1526602820966309
- Rigato M, Monami M, Fadini GP. Autologous Cell Therapy for Peripheral Arterial Disease: Systematic Review and Meta-Analysis of Randomized, Nonrandomized, and Noncontrolled Studies. Circ Res 2017;120(8):1326-1340. (In eng). DOI: 10.1161/circresaha.116.309045
- Beer L, Mildner M, Gyöngyösi M, Ankersmit HJ. Peripheral blood mononuclear cell secretome for tissue repair. Apoptosis 2016;21(12):1336-1353. (In eng). DOI: 10.1007/s10495-016-1292-8
- Gurevich DB, Severn CE, Twomey C, et al. Live imaging of wound angiogenesis reveals macrophage orchestrated vessel sprouting and regression. Embo j 2018;37(13) (In eng). DOI: 10.15252/embj.201797786
- Kwee BJ, Seo BR, Najibi AJ, et al. Treating ischemia via recruitment of antigen-specific T cells. Sci Adv 2019;5(7):eaav6313. (In eng). DOI: 10.1126/sciadv.aav6313
- Li J, Tan J, Martino MM, Lui KO. Regulatory T-Cells: Potential Regulator of Tissue Repair and Regeneration. Front Immunol 2018;9:585. (In eng). DOI: 10.3389/fimmu.2018.00585
- Magenta A, Florio MC, Ruggeri M, Furgiuele S. Autologous cell therapy in diabetes‑associated critical limb ischemia: From basic studies to clinical outcomes (Review). Int J Mol Med 2021;48(3) (In eng). DOI: 10.3892/ijmm.2021.5006
- Krishnasamy K, Limbourg A, Kapanadze T, et al. Blood vessel control of macrophage maturation promotes arteriogenesis in ischemia. Nat Commun 2017;8(1):952. (In eng). DOI: 10.1038/s41467-017-00953-2
- Patel AS, Smith A, Nucera S, et al. TIE2-expressing monocytes/macrophages regulate revascularization of the ischemic limb. EMBO Mol Med 2013;5(6):858-69. (In eng). DOI: 10.1002/emmm.201302752
- Awad O, Dedkov EI, Jiao C, Bloomer S, Tomanek RJ, Schatteman GC. Differential healing activities of CD34+ and CD14+ endothelial cell progenitors. Arterioscler Thromb Vasc Biol 2006;26(4):758-64. (In eng). DOI: 10.1161/01.ATV.0000203513.29227.6f
- Ogle ME, Segar CE, Sridhar S, Botchwey EA. Monocytes and macrophages in tissue repair: Implications for immunoregenerative biomaterial design. Exp Biol Med (Maywood) 2016;241(10):1084-97. (In eng). DOI: 10.1177/1535370216650293
- Wynn TA, Vannella KM. Macrophages in Tissue Repair, Regeneration, and Fibrosis. Immunity 2016;44(3):450-462. (In eng). DOI: 10.1016/j.immuni.2016.02.015
- Minutti CM, Knipper JA, Allen JE, Zaiss DM. Tissue-specific contribution of macrophages to wound healing. Semin Cell Dev Biol 2017;61:3-11. (In eng). DOI: 10.1016/j.semcdb.2016.08.006
- Kimball A, Schaller M, Joshi A, et al. Ly6C(Hi) Blood Monocyte/Macrophage Drive Chronic Inflammation and Impair Wound Healing in Diabetes Mellitus. Arterioscler Thromb Vasc Biol 2018;38(5):1102-1114. (In eng). DOI: 10.1161/atvbaha.118.310703
- Kanter JE, Kramer F, Barnhart S, et al. Diabetes promotes an inflammatory macrophage phenotype and atherosclerosis through acyl-CoA synthetase 1. Proc Natl Acad Sci U S A 2012;109(12):E715-24. (In eng). DOI: 10.1073/pnas.1111600109
- Pannell M, Labuz D, Celik M, et al. Adoptive transfer of M2 macrophages reduces neuropathic pain via opioid peptides. J Neuroinflammation 2016;13(1):262. (In eng). DOI: 10.1186/s12974-016-0735-z
- Persiani F, Paolini A, Camilli D, et al. Peripheral Blood Mononuclear Cells Therapy for Treatment of Lower Limb Ischemia in Diabetic Patients: A Single-Center Experience. Ann Vasc Surg 2018;53:190-196. (In eng). DOI: 10.1016/j.avsg.2018.05.036
- Benoit E, O’Donnell TF, Patel AN. Safety and efficacy of autologous cell therapy in critical limb ischemia: a systematic review. Cell Transplant 2013;22(3):545-62. (In eng). DOI: 10.3727/096368912×636777
- Ai M, Yan CF, Xia FC, Zhou SL, He J, Li CP. Safety and efficacy of cell-based therapy on critical limb ischemia: A meta-analysis. Cytotherapy 2016;18(6):712-24. (In eng). DOI: 10.1016/j.jcyt.2016.02.009
- Bitar MS. Diabetes Impairs Angiogenesis and Induces Endothelial Cell Senescence by Up-Regulating Thrombospondin-CD47-Dependent Signaling. Int J Mol Sci 2019;20(3) (In eng). DOI: 10.3390/ijms20030673
- Fadini GP, Albiero M, Bonora BM, Avogaro A. Angiogenic Abnormalities in Diabetes Mellitus: Mechanistic and Clinical Aspects. J Clin Endocrinol Metab 2019;104(11):5431-5444. (In eng). DOI: 10.1210/jc.2019-00980
- Panunzi A, Madotto F, Sangalli E, et al. Results of a prospective observational study of autologous peripheral blood mononuclear cell therapy for no-option critical limb-threatening ischemia and severe diabetic foot ulcers. Cardiovasc Diabetol 2022;21(1):196. (In eng). DOI: 10.1186/s12933-022-01629-y
- Ragghianti B, Piaggesi A, Mannucci E, Monami M. Effects of local antibiotics in calcium-sulphate granules for the treatment of diabetic forefoot osteomyelitis: a propensity-matched observational study. Journal of Wound Management 2023;24(2):Epub-ahead of print
- Scatena A, Petruzzi P, Maioli F, et al. Autologous Peripheral Blood Mononuclear Cells for Limb Salvage in Diabetic Foot Patients with No-Option Critical Limb Ischemia. J Clin Med 2021;10(10) (In eng). DOI: 10.3390/jcm10102213
- Ragghianti B, Berardi BM, Mannucci E, Monami M. Autologous Peripheral Blood Mononuclear Cells in Patients with Small Artery Disease and Diabetic Foot Ulcers: Efficacy, Safety, and Economic Evaluation. J Clin Med 2023;12(12) (In eng). DOI: 10.3390/jcm12124148